Las aminas son fuertemente polares debido a que el gran momento dipolar del par de electrones solitario se suma a los momentos dipolares de los enlaces C-N y H-N.
El enlace del hidrógeno N-H es más débil que el enlace hidrógeno O-H, por tanto las aminas tienen puntos de ebullición más bajos que los alcoholes con masas moleculares similares. Del mismo modo, en las aminas primarias y secundarias se tienen enlaces de hidrógeno, por lo cual ellas presentan puntos de ebullición más altos que los de los hidrocarburos de peso moleculares similares; en éstos los enlaces de hidrógeno son más fuertes. Las aminas terciarias tienen puntos de ebullición menores que las primarias o secundarias de pesos moleculares comparables, ya que, como en las terciarias no hay enlaces N-H, ellas no presentan enlaces de hidrógeno.
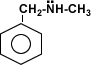 Amina Secundaria Aromática
Amina Secundaria Aromáticahttp://www.salonhogar.net/quimica/nomenclatura_quimica/T11Dib2A.gif

https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEiAWEn8cXDD6tpFT6hEi9IYQvbEaTsWhyphenhyphen0EgCMSXu-sUkUAadmM4b-2b4nLFDqDFK-eL5VJoBQK-FC3mlUD2YZdC2uoaMJjb4IpyyVziZci8YNdiKCbS4smlAOyBmtQT0ipyc48EBWx4gg/s400/00016897.jpg
Las aminas de pesos moleculares bajos son bastantes solubles en agua, ya que se presenta enlazamiento de hidrógeno entre las moléculas de la amina y las del agua. Son solubles en disolventes menos polares, como éter, alcohol, benceno, entre otros. Las metil y etilaminas huelen muy semejante al amoniaco. Las alquilaminas superiores tienen olor a pescado en descomposición. Las aminas aromáticas suelen ser muy tóxicas ya que son absorbidas por la piel, con resultados a menudo fatales. Las aminas aromáticas se oxidan fácilmente al aire y con frecuencia se las encuentra coloreadas por productos de oxidación, aunque son incoloras cuando están puras.
No hay comentarios:
Publicar un comentario