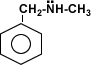
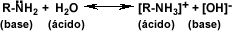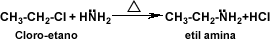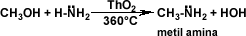-Grolier, tomo #3, "enciclopedia combi visual", pág 310
-Tomo #2, "Biologia", quinta edición, Helena Cutis, N. Sue Barnes, pag 542
-Helmer Pardo, Grupo educativo, "Manual de Quimica", 2003, pag 36
-http://www.quimicaorganica.net/sites/quimicaorganica.net/files/img/organica/aminas/nomenclatura/aminas-clasificacion.gif
-http://4.bp.blogspot.com/_bXMzTl1o7G4/SDJTMWReY7I/AAAAAAAAACs/quINZSQfmtA/s200/amida.png
-http://html.rincondelvago.com/0000383843.png
-http://www.terrasakra.es/img/aventurat/redimensionar.php?imagen=Ciervo2.jpg
-http://alimentosproteinas.com/img-alimentosproteinas.com/alimentos-proteinas-carne-pescado-huevos.jpg
-http://www.salonhogar.net/quimica/nomenclatura_quimica/T11Dib4.gif
-http://www.salonhogar.net/quimica/nomenclatura_quimica/T11Dib5.gif
-http://www.salonhogar.net/quimica/nomenclatura_quimica/T11Dib6.gif
-http://www.salonhogar.net/quimica/nomenclatura_quimica/T11Dib2A.gif
-https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEiAWEn8cXDD6tpFT6hEi9IYQvbEaTsWhyphenhyphen0EgCMSXu-sUkUAadmM4b-2b4nLFDqDFK-eL5VJoBQK-FC3mlUD2YZdC2uoaMJjb4IpyyVziZci8YNdiKCbS4smlAOyBmtQT0ipyc48EBWx4gg/s400/00016897.jpg
-http://www.guatequimica.com/tutoriales/aminas/metilamina.gif
-http://www.guatequimica.com/tutoriales/aminas/dimetilamina.gif
-http://www.guatequimica.com/tutoriales/aminas/trimetilamina.gif
Gracias por su atención
http://t0.gstatic.com/images?q=tbn:ANd9GcSD-p_uAo0rfSwJ42k46oXRZ4BDFw0CG379urDZ1fXsrNXAUBsPFA